Cập nhật lần cuối vào 06/04/2023
Vối là một dược liệu (bao gồm lá và nụ Vối) được dùng khá phổ biến trong dân gian để làm trà uống thanh nhiệt, giải độc, trợ tiêu hóa, chữa kiết lỵ. Dùng ngoài để rửa mụn nhọt, vết loét. Các nghiên cứu cho thấy cây có thành phần chính là tinh dầu, flavonoid và tannin [1]. Trên thế giới, về tác dụng nụ Vối được nghiên cứu về hoạt tính chống oxi hóa, chống viêm nhiễm, kháng vi sinh vật; về hóa học được nghiên cứu về thành phần tinh dầu, flavonoid, terpenoid trong khi đó các công bố về lá Vối hãy còn khá ít [2]. Ở nước ta hiện cũng rất hiếm công trình nghiên cứu có hệ thống về lá của cây này. Do đó, chúng tôi tiến hành thực hiện đề tài “Nghiên cứu thành phần hóa học hướng tác dụng chống oxy hóa của lá cây Vối (Cleistocalyx operculatus Roxb.)” để bổ sung các dữ liệu về hóa học và sinh học của cây này, làm tiền đề cho các nghiên cứu tiếp theo.
Nguyên liệu
Nguyên liệu là lá của cây Vối thu hái tại Củ Chi, TP. HCM. Mẫu dược liệu đã được TS. Võ Văn Chi, nguyên giảng viên Bộ môn Dược liệu, Đại học Y Dược TP. Hồ Chí Minh, xác định tên khoa học là Cleistocalyx operculatus (Roxb.) Merr. et Perry, thuộc họ Sim (Myrtaceae). Mẫu nghiên cứu hiện đang được lưu giữ tại Bộ môn Dược liệu, Khoa Dược, Đại học Y Dược TP. Hồ Chí Minh.
Phương pháp nghiên cứu
Phương pháp chiết xuất và phân lập
10 kg lá Vối được chiết ngấm kiệt với ethanol 70%, thu được 7 L dịch chiết, cô quay áp suất giảm thu được 1,05 kg cao đậm đặc. Cao được đem pha loãng với nước, chiết phân bố lỏng-lỏng với các dung môi có độ phân cực tăng dần là n-hexan, dicloromethan, ethyl acetat thu được cao n-hexan (107,6g); cao cloroform (118,9g); cao ethyl acetat (169,1g).
Khảo sát tác dụng chống oxy hóa của 4 loại cao chiết: cao n-hexan, cao cloroform, cao ethyl acetat và cao nước. Kết quả cho thấy hoạt tính chống oxy hóa giảm dần theo thứ tự là cao ethyl acetat (82,05%) > cloroform (25,38%) > cao nước (24,83%) > cao n-hexan (14,63%). Trong số này, cao ethyl acetat là cao có tác dụng mạnh và được chọn để khảo sát tiếp thành phần hóa học.
Từ 70 g cao EtOAc, bằng sắc ký cột với hệ dung môi cloroform – ethyl acetat với tỷ lệ ethyl acetat tăng dần: 100à(95:5)à(90:10)à(80:20)àethyl acetat (100%) … thu được 9 phân đoạn:
Từ phân đoạn E8 thu được chất 1, đặt tên là CO1 (81,61 mg), là một chất ở dạng bột vô định hình màu vàng đậm. Từ phân đoạn E5 thu được chất 2, đặt tên là CO3A (52 mg), là chất ở dạng bột vô định hình màu vàng nhạt. Từ phân đoạn E3 thu được chất 3, đặt tên là CO4 (56 mg), là chất ở dạng bột màu vàng tươi.
Cấu trúc các chất phân lập được xác định bằng phổ MS và NMR (đo trên máy Bruker AM500 FT-NMR tại Viện Hàn lâm khoa học và công nghệ Việt Nam)
Khảo sát tác dụng chống oxy hóa
Các chất nghiên cứu có tác dụng chống oxy hóa theo cơ chế dập tắt gốc tự do sẽ làm giảm màu của DPPH, xác định khả năng này bằng cách đo quang ở bước sóng 517 nm.
Chuẩn bị
Dung dịch DPPH: pha dung dịch DPPH 0,5 mM trong methanol pha xong dùng ngay, đựng trong lọ thủy tinh màu.
Pha dung dịch đối chiếu acid ascorbic nồng độ: 2, 3, 4, 6, 8, 10, 12, 14, 18 μg/ml trong MeOH để xác định IC50 và so sánh kết quả với mẫu thử.
Khảo sát hoạt tính đánh bắt gốc tự do DPPH của 5 mẫu cao: toàn phần (TP), n-hexan (H), cloroform (C), ethyl acetat (EA), nước (N). Các mẫu cao được pha ở cùng nồng độ 18 µg/ml trong methanol. Nếu mẫu khó tan, trợ tan bằng DMSO với tỷ lệ xác định.
Khảo sát động học: xác định thời gian phản ứng giữa dung dịch thử và dung dịch DPPH đến khi xảy ra hoàn toàn, độ hấp thu ổn định.
Mẫu đo: thực hiện phản ứng trong lọ màu nâu.
Các phản ứng phải thực hiện ở chỗ tối, sau 30 phút đến khi ổn định thì đo quang ở bước sóng 517 nm.
Bảng 1. Cách pha mẫu đo của phương pháp DPPH.
| Ống | Dung dịch thử (ml) | Dung môi MeOH (ml) | Dung dịch DPPH (ml) |
| Trắng | 0 | 4 | 0 |
| Chứng | 0 | 3,5 | 0,5 |
| Thử | 1 | 2,5 | 0,5 |
Tính toán kết quả: Hoạt tính chống oxy hóa (HTCO) của dung dịch thử được tính theo công thức: HTCO (%) = [(Abschứng – Absthử)/ (Abschứng – Abstrắng)] x 100
Abs: độ hấp thu đo được ở 517 nm.
Xác định IC50
IC50 là nồng độ mà tại đó chất thử loại bỏ được 50% gốc tự do DPPH.
Cách tính giá trị IC50: pha một giai mẫu có ít nhất 5 nồng độ, trong đó phải bao hàm nồng độ cho HTCO 50%, vẽ đồ thị biểu diễn sự phụ thuộc của HTCO (%) theo nồng độ chất khảo sát bằng phầm mềm excel. Từ đồ thị, nội suy ra giá trị nồng độ có HTCO 50% tức là IC50 từ phương trình hồi quy tuyến tính có dạng y = ax + b thế y = 50 vào để suy ra IC50.
Kết quả thử tác dụng chống oxy hóa của các mẫu theo phương pháp DPPH
Tiến hành khảo sát hoạt tính chống oxy hóa in vitro của các chất tinh khiết phân lập được: cao EtOAc, Chất 1, Chất 2, Chất 3. So sánh IC50 của các mẫu thử với với chất đối chiếu (acid ascorbic).
Kết quả và bàn luận
Xác định cấu trúc các chất phân lập
Chất 1 (CO1):
Phổ MS: phổ MS– của CO1 cho mảnh m/z [M-H]– 301, cho biết CO1 có M = 302 ứng với công thức phân tử C15H10O7 (Ω = 11).
Phổ UV của CO1 đo trong MeOH cho λmax ở 255,4 và 371,9 nm. Đây chính là dạng phổ UV điển hình của phân nhóm flavon/ flavonol.
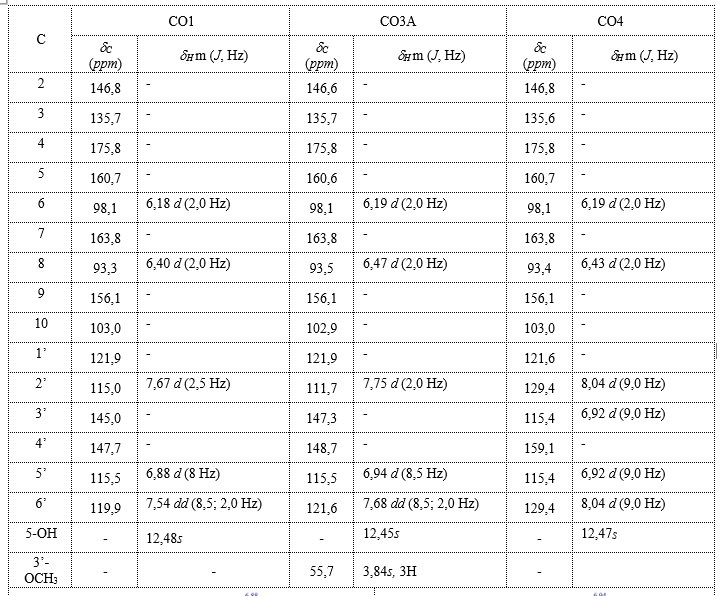
Phổ 13C-NMR của CO1 có 15 tín hiệu Carbon, có δCmax 175,8 < 180 ppm nên định hướng đây là một flavonol aglycon đơn giản. Nhận thấy có tất cả 8 C-IV trong vùng trường thấp
135 – 175 ppm; loại trừ vị trí C2, C4, C9; suy ra, CO1 có 5 nhóm thế oxy cụ thể là 5 nhóm -OH. Trong đó có một nhóm tại vị trí C3.
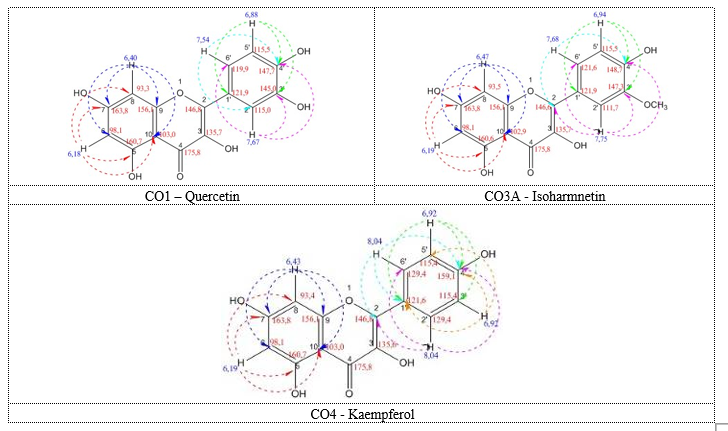
Phổ 13C có tín hiệu δC 93,3 ppm và δC 98,1 ppm lần lượt là tín hiệu của C8 và C6. Do đó, C8 và C6 chưa bị thế. Phổ 1H cho 1 tín hiệu của -OH phenol có độ dịch chuyển là 12,95 ppm đặc trưng cho 5-OH. Ngoài ra, quan sát thấy có 2 tín hiệu H là δH 6,40 d (2 Hz) và 6,18 d (2 Hz) kết hợp với phân tích dữ liệu HMBC, xác định có 2 nhóm -OH tại vị trí C5 và C7 của vòng A. Phổ 1H còn cho thấy bộ tín hiệu δH 7,67 d (2 Hz); 7,53 dd (8,2 Hz); 6,88 d (8 Hz); kết hợp với phân tích dữ liệu HMBC; xác định 2 nhóm –OH còn lại tại vị trí C3’ và C4’.
Vậy, sơ bộ kết luận CO1 là một flavonol gồm 15C, có 5 nhóm OH ở 5 vị trí C3, C5, C7, C3’ và C4’. Từ kết quả này và kết quả MS, định hướng đây là quercetin. Các dữ liệu của CO1 đều rất phù hợp với quercetin trong tài liệu tham khảo [3, 4]. Như vậy, có thể khẳng định CO1 chính là quercetin (Bảng 2).
Chất 2 (CO3A)
Phổ MS: phổ MS– của CO3A cho mảnh m/z [M-H]– 315, cho biết CO3A có M = 316 ứng với công thức phân tử C16H12O7 (Ω = 11)
Phổ UV của CO3A đo trong MeOH cho λmax ở 254,2 và 370,7 nm. Đây chính là dạng phổ UV điển hình của phân nhóm flavon/ flavonol.
Phổ NMR của CO3A có 16 tín hiệu carbon, có δCmax 175,8 < 180 ppm nên định hướng đây là một flavonol aglycon có 1 nhóm thế. Nhận thấy có tất cả 8 C-IV trong vùng trường thấp
135–175 ppm; loại trừ vị trí C2, C4, C9; suy ra, CO3A có 5 nhóm thế oxy. Trong đó có 1 nhóm tại vị trí C3.
Phổ 13C có tín hiệu δC 93,5 ppm và δC 98,1 ppm lần lượt là tín hiệu của C8 và C6. Do đó, C8 và C6 chưa bị thế. Phổ 1H cho 1 tín hiệu của -OH phenol có độ dịch chuyển là 12,45 ppm đặc trưng cho 5-OH. Ngoài ra, quan sát thấy có 2 tín hiệu H là
δH 6,47 d (2 Hz),1H và 6,19 d (2 Hz),1H kết hợp với phân tích dữ liệu HMBC, xác định có 2 nhóm -OR tại vị trí C5 và C7 của vòng A. Phổ 1H còn cho thấy bộ tín hiệu δH 7,75 d (2 Hz),1H; 7,68 dd (8,5;2,0 Hz),1H; 6,94 d (8,5 Hz),1H; kết hợp với phân tích dữ liệu HMBC; xác định 2 nhóm –OR còn lại tại vị trí C3’ và C4’.
Trên phổ 13C có tín hiệu δC 55,7 ppm và phổ 1H cho tín hiệu δH 3,84s, 3H, đây là tín hiệu của nhóm methoxy –OCH3; kết hợp với phân tích dữ liệu HMBC, xác định nhóm –CH3 gắn vào vị trí C3’.
Vậy, sơ bộ kết luận CO3A là một flavonol gồm 16C, có 4 nhóm OH ở 5 vị trí C3, C5, C7, và C4’ và 1 nhóm –OCH3 ở vị trí C3’. Từ kết quả này và kết quả MS, định hướng đây là isoharmnetin. Các dữ liệu của CO3A đều rất phù hợp với isoharmnetin trong tài liệu tham khảo [3, 5]. Như vậy, có thể khẳng định CO3A là isoharmnetin (Bảng 2).
Chất 3 (CO4)
Phổ MS: phổ MS– của CO4 cho mảnh m/z [M-H]– 285, cho biết CO4 có M = 286 ứng với công thức phân tử C15H10O6 (Ω = 11).
Phổ UV của CO4 đo trong MeOH cho λmaxở 264,9 và 367,1 nm. Đây chính là dạng phổ UV điển hình của phân nhóm flavon/ flavonol.
Phổ NMR của CO4 có 15 tín hiệu Carbon, có δCmax 175,8 < 180 ppm nên định hướng đây là một flavonol aglycon đơn giản. Nhận thấy có tất cả 7 C-IV trong vùng trường thấp
135–175 ppm; loại trừ vị trí C2, C4, C9; suy ra, CO4 có 4 nhóm thế oxy cụ thể là 4 nhóm
-OH. Trong đó có 1 nhóm tại vị trí C3. Ngoài ra tại vùng δC 100-135 ppm, có 2 tín hiệu C đối xứng, khoảng cách giữa 2 tín hiệu đối xứng này là 14,06 ppm, nên có thể kết luận có 1 nhóm –OH tại vị trí C4’. Phổ 13C có tín hiệu δC 93,4 ppm và δC 98,1 ppm lần lượt là tín hiệu của C8 và C6. Do đó, C8 và C6 chưa bị thế. Phổ 1H cho 1 tín hiệu của -OH phenol có độ dịch chuyển là 12,47 ppm đặc trưng cho 5-OH. Ngoài ra, quan sát thấy có 2 tín hiệu H là
δH 6,43 d (2 Hz),1H và 6,19 d (2 Hz),1H kết hợp với phân tích dữ liệu HMBC, xác định có 2 nhóm –OH tại vị trí C5 và C7 của vòng A. Phổ 1H còn cho thấy bộ tín hiệu δH 8,04 d (9 Hz),2H; 6,92 d (9 Hz),2H; kết hợp với phân tích dữ liệu HMBC; xác định có 2 C đối xứng ở vị trí lần lượt là C2’, C6’ và C3’, C5’.
Vậy, sơ bộ kết luận CO4 là một flavonol gồm 15C, có 4 nhóm OH ở 4 vị trí C3, C5, C7, và C4’. Từ kết quả này và kết quả MS, định hướng đây là kaempferol và tiến hành so phổ. Các dữ liệu của CO4 đều rất phù hợp với kaempferol trong tài liệu tham khảo [3, 4]. Như vậy, có thể khẳng định CO4 là kaempferol (Bảng 2).
Bảng 2. Dữ liệu phổ NMR của CO1, CO3A và CO4 (đo trong DMSO-d6)
Khảo sát tác dụng chống oxy hóa các chất phân lập
Các chất tinh khiết phân lập từ cao ethyl acetat có HTCO giảm dần theo thứ tự quercetin (IC50= 2,13 µg/ml) > isoharmnetin (IC50= 3,22 µg/ml) và kaempferol (IC50= 3,29 µg/ml). Trong đó quercetin có hoạt tính chống oxy hóa mạnh hơn cao EA (IC50= 2,58 µg/ml) và mạnh hơn so với chất đối chiếu acid ascorbic (IC50= 2,28 µg/ml). Hai chất còn lại isoharmnetin và kaempferol đều có hoạt tính chống oxy hóa kém hơn cao ethyl acetat và acid ascorbic.
Kết luận
Từ phân đoạn cao ethyl acetat từ lá của cây Vối Cleistocalyx operculatus (Roxb.) Merr. et Perry thu mua tại quận Thủ Đức, Tp. Hồ Chí Minh đã phân lập và xác định được 3 flavonoid là quercetin, isoharmnetin và kaempferol.
Nghiên cứu này cho thấy quercetin có hoạt tính chống oxy hóa mạnh nhất với IC50= 2,13 µg/ml mạnh hơn so với chất đối chiếu acid ascorbic (IC50= 2,28 µg/ml). Hai chất còn lại isoharmnetin (IC50= 3,22 µg/ml) và kaempferol (IC50= 3,29 µg/ml) đều có hoạt tính chống oxy hóa và kém hơn so với chất đối chiếu acid ascorbic.
Tài liệu tham khảo
- Cleitocalyx operculatus”, Acta Botanica, 32 (6), pp. 469 – 472.
- Min B.-S., Thu C.V., Dat N. T., Dang N. H., Jang H.-S., Hung T.M. (2008), “Antinoxidative flavonoids from Cleitocalyx operculatus buds”, Chemical pharmaceutical Bulletin 56(12), pp. 1725 – 1728.
- Rune Slimestad (2007), “Reviews on Onions: A Source of Unique Dietary Flavonoids”, Journal of Agricutural and Food Chemistry”, pp. 10067 – 10080.
- Young Hae Choi, Hye Kyong Kim, Huub J.M. Linthorst, Johan G. Hollander, Alfons W. M. Lefeber, Cornelis Erkelens, Jean-Marc Nuzillard, Robert Verpoorte (2006), “NMR Metabolomics to Revisit the Tobaco Mosaic Virus Infection in Nicotaina tabacum Leaves”,The American Chemical Society and American Society of Pharmacognosy, pp. 742 – 748.
Nhóm NCKH
BM Dược liệu – Thực vật




